De ulike kodene i cellen
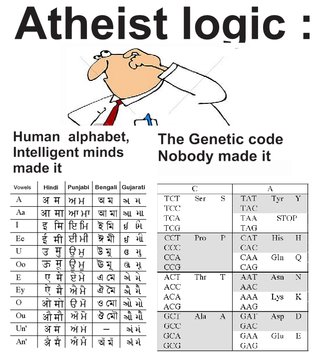 Hentet herfra.
Hentet herfra.
Den irredusible, gjensidig avhengigheten av informasjonsgenererings- og overføringssystemer
1. Kodifisert informasjonsoverføringssystem avhenger av:
a) Et språk der et symbol, bokstaver, ord, bølger eller frekvensvariasjoner, lyder, pulser eller en kombinasjon av disse er tilordnet noe annet. å tilordne betydning til tegn, gjennom et kodesystem krever en felles meningsavtale. Statistikk, semantikk, syntaks og pragmatikk brukes i henhold til kombinatoriske, kontekstavhengige og innholds-koherente regler.
b) Informasjon kodet gjennom den koden,
c) et informasjonslagringssystem,
d) Et informasjonsoverføringssystem, d.v.s. koding, overføring og dekoding.
e) Etter hvert oversettelse (tilordning av betydning fra ett språk til et annet)
f) Til slutt konvertering (digital-analog konvertering, modulatorer, forsterkere)
g) Til slutt transduksjon som konverterer de ikke-elektriske signalene til elektriske signaler
2. I levende celler blir informasjon kodet gjennom minst 30 genetiske og nesten 30 epigenetiske koder som danner ulike sett med regler og språk. De overføres på en rekke måter, det vil si cellecilia som sentrum for kommunikasjon, microRNAs påvirkende cellefunksjon, nervesystemet, systemets synaptiske overføring, nevromuskulær overføring, overføring via nerver og kroppsceller, aksoner som ledninger, overføring av elektriske impulser av nerver mellom hjerne & reseptor / målceller, vesikler, eksosomer, blodplater, hormoner, biofotoner, biomagnetisme, cytokiner og kjemokiner, forseggjorte kommunikasjonskanaler relatert til forsvar mot mikrobeangrep, kjerner som modulator-forsterkere.
Disse informasjonsoverføringssystemene er avgjørende for å opprettholde alle biologiske funksjoner, det vil si organisk vekst og utvikling, metabolisme, regulering av ernæringskrav, kontroll av reproduksjon, homeostase, konstruering av biologisk arkitektur, 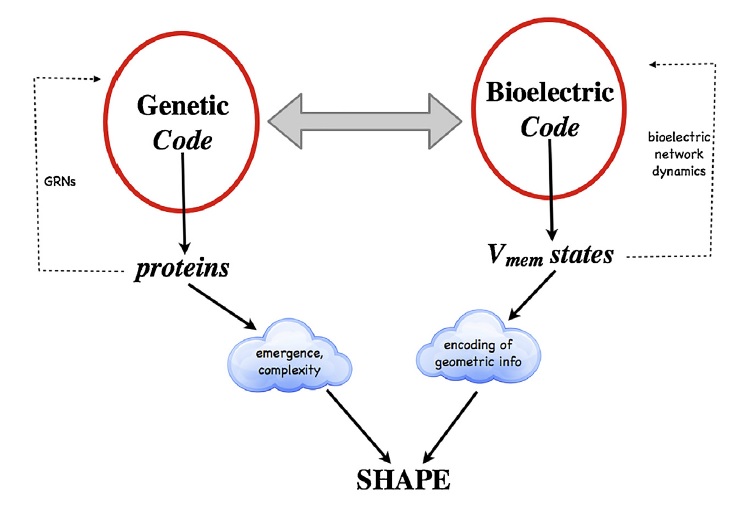 kompleksitet, form, kontrollering av organismenes tilpasning, endring, regenerering/reparasjon og å fremme overlevelse.
kompleksitet, form, kontrollering av organismenes tilpasning, endring, regenerering/reparasjon og å fremme overlevelse.
3. Opprinnelsen til slike komplekse kommunikasjonssystemer forklares best ved en intelligent designer. Siden ingen mennesker var involvert i å lage disse komplekse databehandlingssystemene, må en overmenneskelig superintelligent kilde, ha vært skaperen av kommunikasjonssystemene som ble brukt i livet.
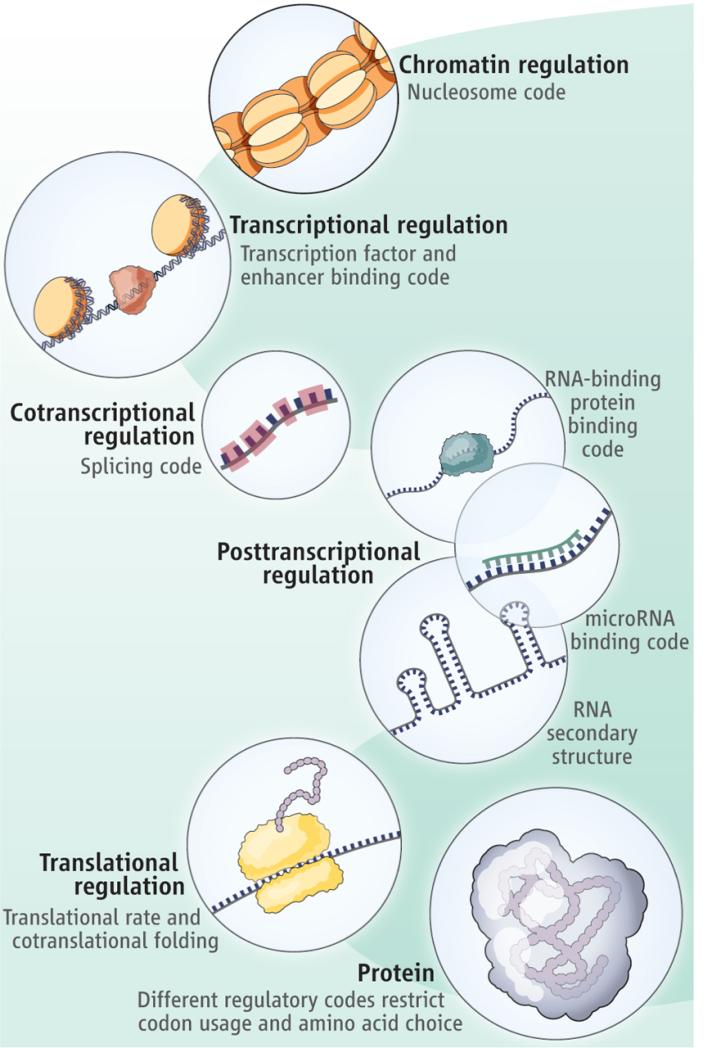
Ulike-reguleringskoder-i-cellene -Eks. bilde t.h:
1. De over 30 ulike genetiske kodene
2. Adhesjonskoden
3. Apoptosekoden
4. Den bioelektriske koden
5. Biophoton-koden
6. Kalsiumkoden
7. Chaperon-koden
8. Kromatin-koden
9. Det sirkulære motiv (ribosom) kode
10. Coaktivator/corepressor/epigenetisk kode
11. Menneskelig språk-kode (universell)
12. Den skjulte koden innenfor den genetiske koden
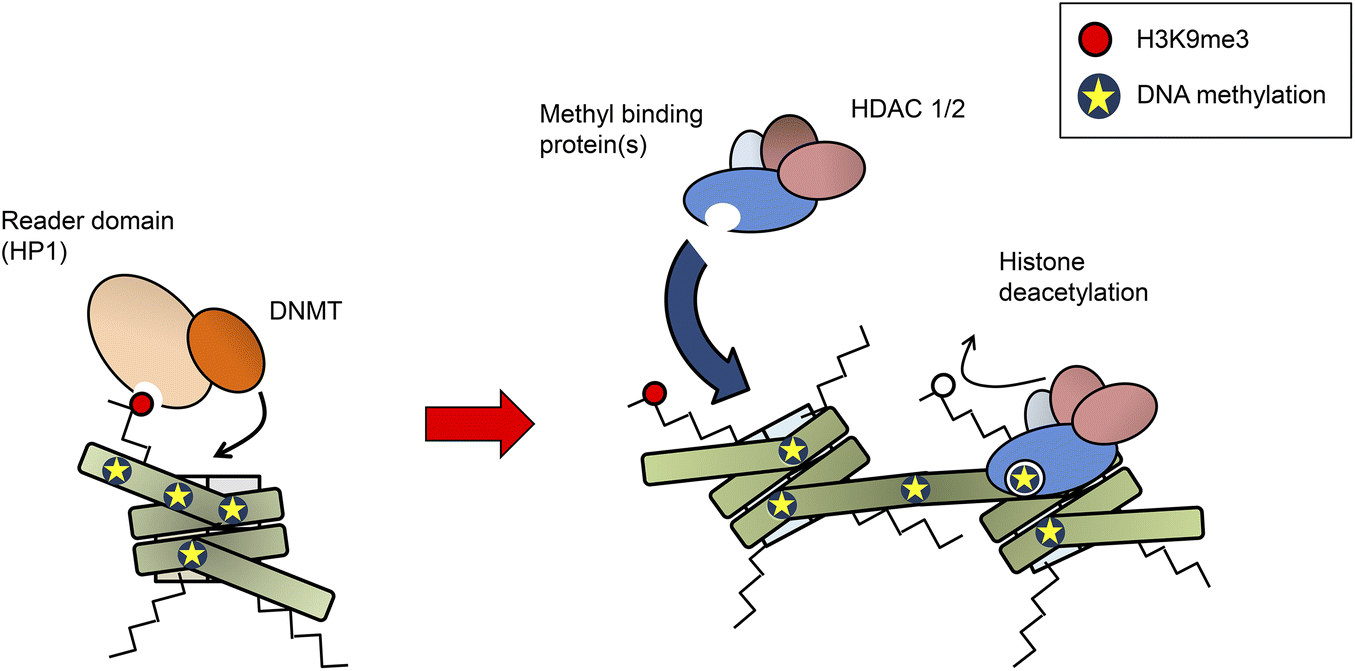 13. DNA-metyleringskoden
13. DNA-metyleringskoden
14. Differensieringskoden
15. Domenesubstratspesifisitetskoden for ikke-ribosomale peptidsyntetaser (NRPS)
16. Feilkorrigeringskode
17. Genomisk reguleringskode
18. Glykomikoden
19. Histonkoden
20. HOX-koden
21. Lamin-koden
22. Metabolsk kode
23. Myelin-koden
24. Nevronal tagg-rate kode
25. Den ikke-ribosomale koden
26. Nukleosomkoden
27. Olfaktorisk kode
28. Operon-koden
29. Fosforyleringskoden
30. Post-translationell modifikasjonskode for transkripsjonsfaktorer
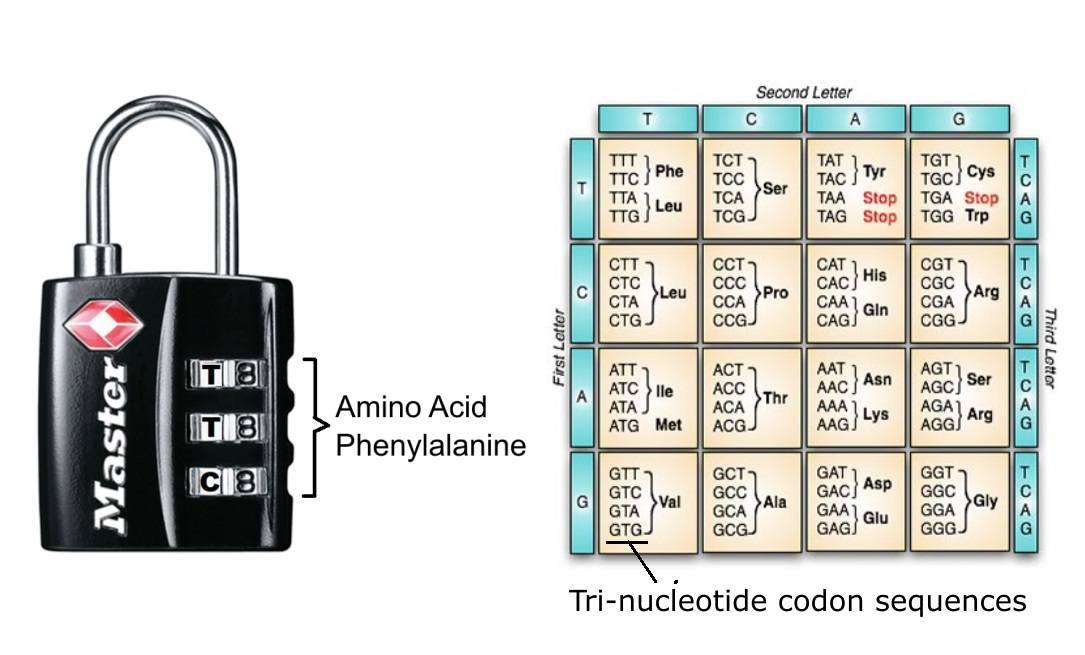 31. RNA-koden
31. RNA-koden
32. Ribosomal kode
33. Ribosvitsj-koden
34. Skjøtekodene
35. Signaltransduksjonskoden(e)
36. Signalintegrasjonskodene
37. Sukkerkoden
38. Den synaptiske limkoden
39. Transkripsjonsfaktorkoden
40. Transkripsjons-cis-regulerende kode
41. Tubulin-koden
42. Ubiquitin-koden
 Transkripsjonsfaktorkoden: Det å definere rollen til en utviklings transkripsjonsfaktor i den voksne hjernen. For at den menneskelige hjerne skal utvikle seg og fungere riktig, må hver av dens 100 milliarder nevroner følge en spesifikk og forhåndsprogrammert kode for genuttrykk. Denne koden er drevet av viktige transkripsjonsfaktorer som regulerer uttrykket av mange proteiner, og støper nevronenes identitet for å skape deres unike form og elektriske oppførsel.
Transkripsjonsfaktorkoden: Det å definere rollen til en utviklings transkripsjonsfaktor i den voksne hjernen. For at den menneskelige hjerne skal utvikle seg og fungere riktig, må hver av dens 100 milliarder nevroner følge en spesifikk og forhåndsprogrammert kode for genuttrykk. Denne koden er drevet av viktige transkripsjonsfaktorer som regulerer uttrykket av mange proteiner, og støper nevronenes identitet for å skape deres unike form og elektriske oppførsel.
https://www.findaphd.com/search/projectdetails.aspx?PJID=41943
Å avdekke en ny transkripsjonsfaktorkode som bestemmer den menneskelige arterielle spesifikke endotel-cellesignaturen
Vår banebrytende profilstudie på nyisolerte EC-er avdekket en kombinatorisk transkripsjonskode som induserte et arterielt fingeravtrykk mer dyktig enn den nåværende gullstandarden, HEY2, og denne kode inneholdt en in vivo arteriell oppførsel på venøs EC.
http://www.bloodjournal.org/content/122/24/3982?sso-checked=true
Transkripsjonsreguleringskoden til eukaryote celler - innsikt fra genomomfattende analyse av kromatinorganisasjon og transkripsjonsfaktorbinding.
Begrepet 'transkripsjonsreguleringskode' har blitt brukt for å beskrive samspillet mellom disse hendelsene i den komplekse kontrollen av transkripsjon. Med modningen av metoder for å oppdage in vivo protein-DNA-interaksjoner i en genomskala, er detaljerte kart over kromatinfunksjoner og transkripsjonsfaktorlokalisering over hele genomer av eukaryote celler, berikende vår forståelse av egenskapene og naturen til denne transkripsjonelle regulatoriske koden.
http://www.ncbi.nlm.nih.gov/pubmed/16647254
Glykan eller sukkerkoden
Overføring av biologisk informasjon utover den genetiske koden: sukkerkoden
http://www.ncbi.nlm.nih.gov/pubmed/10798195
Den ikke-ribosomale koden
A tillot identifisering av aminosyrerester som spiller en avgjørende rolle i koordineringen av substratet og har ført til konseptet med den såkalte nonribosomale koden, som tillater prediksjon av A-domeneselektivitet på grunnlag av dens primære sekvens
https://www.duo.uio.no/bitstream/handle/10852/11331/DUO_668_ToomingKlunderud_17x24.pdf?sequence=1
 KONTROLL AV OMSKRIFT VED SEKVENSER SPESIFIKKE DNA-BINDENDE PROTEINER
KONTROLL AV OMSKRIFT VED SEKVENSER SPESIFIKKE DNA-BINDENDE PROTEINER
Kodet informasjon kan alltid spores tilbake til en intelligens, som må sette opp konvensjonens betydning av koden, og informasjonsbæreren, som kan være en bok, maskinvaren til en datamaskin eller røyken fra en brann fra en indianer stamme som signaliserer til en annen. Alle kommunikasjonssystemer har en koder som produserer en melding som behandles av en dekoder. I cellen er det flere kodesystemer. DNA er den mest kjente, den lagrer kodet informasjon gjennom de fire nukleinsyrebasene. Men det er flere andre, mindre kjent. Nylig var det noe støy om en annen DNA-kode. Det er faktisk viktig for uttrykk for gener. Cellen bruker flere formelle kommunikasjonssystemer i henhold til Shannons modell fordi de koder og dekoder meldinger ved hjelp av et symbolsystem. Som Shannon skrev:
"Informasjon, transkripsjon, oversettelse, kode, redundans, synonym, budbærer, redigering og korrekturlesing er alle passende begreper i biologi. De tar sin mening fra informasjonsteorien (Shannon, 1948) og er ikke synonymer, metaforer eller analogier."
(Hubert P. Yockey, Information Theory, Evolution, and the Origin of Life, Cambridge University Press, 2005).
En organismes DNA koder for alle RNA- og proteinmolekylene som kreves for å konstruere cellene. Likevel gjør en fullstendig beskrivelse av DNA-sekvensen til en organisme - det være seg de få millioner nukleotidene til en bakterie eller de få milliarder nukleotidene til et menneske - ikke mer oss i stand til å rekonstruere organismen enn en liste med engelske ord gjør det mulig for oss å rekonstruere et spill av Shakespeare. I begge tilfeller er problemet å vite hvordan elementene i DNA-sekvensen eller ordene på listen brukes. Under hvilke forhold lages hvert genprodukt, og når det er laget, hva gjør det? De forskjellige celletyper i en flercellet organisme skiller seg dramatisk både i struktur og funksjon. Hvis vi for eksempel sammenligner et pattedyrs neuron med en levercelle, er forskjellene så ekstreme at det er vanskelig å forestille seg at de to cellene inneholder samme genom. Genomet til en organisme inneholder instruksjonene for å lage alle forskjellige celler, og ekspresjonen av enten en nervecelle eller levercelle kan reguleres i mange av trinnene i veien fra DNA til RNA til protein.
Den viktigste saken er KONTROLL AV TRANSKRIPSJON AV SEKVENSSPESIFIKKE DNA-BINDINGS PROTEINER, kalt transkripsjons- faktorer eller regulatorer. Disse proteinene gjenkjenner spesifikke DNA-sekvenser (vanligvis 5-10 nukleotidpar i lengde) som ofte kalles cis-regulatoriske sekvenser. Transkripsjonsregulatorer binder seg til disse sekvensene, som er spredt gjennom genomene, og denne bindingen setter i gang en serie reaksjoner som til slutt spesifiserer hvilke gener som skal transkriberes og med hvilken hastighet. Omtrent 10% av proteinkodende gener fra de fleste organismer 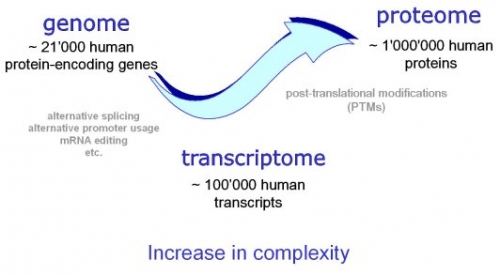 er viet til transkripsjonsregulatorer. Transkripsjonsregulatorer må gjenkjenne korte, spesifikke cis-regulatoriske sekvenser innenfor denne strukturen. Utsiden av den dobbelte heliksen er fylt med DNA-sekvensinformasjon som transkripsjonsregulatorer gjenkjenner: kanten på hvert basepar viser et særegent mønster av hydrogenbindings-givere, hydrogenbindings-akseptorer og hydrofobe flekker i både store og mindre spor. De rundt 20 kontaktene som vanligvis dannes ved protein-DNA-grensesnittet, legges sammen for å sikre at interaksjonen både er veldig spesifikk og veldig sterk.
er viet til transkripsjonsregulatorer. Transkripsjonsregulatorer må gjenkjenne korte, spesifikke cis-regulatoriske sekvenser innenfor denne strukturen. Utsiden av den dobbelte heliksen er fylt med DNA-sekvensinformasjon som transkripsjonsregulatorer gjenkjenner: kanten på hvert basepar viser et særegent mønster av hydrogenbindings-givere, hydrogenbindings-akseptorer og hydrofobe flekker i både store og mindre spor. De rundt 20 kontaktene som vanligvis dannes ved protein-DNA-grensesnittet, legges sammen for å sikre at interaksjonen både er veldig spesifikk og veldig sterk.
Disse instruksjonene er skrevet på et språk som ofte kalles 'genreguleringskoden'. Foretaket for et gitt nukleotid ved en spesifikk posisjon bestemmes hovedsakelig av fysiske interaksjoner mellom aminosyresidekjedene til TF (TranskripsjonsFaktorer) og de tilgjengelige sidene av baseparene som blir kontaktet. Det er mulig at en eller annen kompleks kode, som inneholder regler fra hvert av de forskjellige lagene, bidrar til TF-DNA-binding; å bestemme de nøyaktige reglene for TF-binding til genomet vil imidlertid kreve ytterligere vitenskapelig forskning. Så, genomer inneholder både en genetisk kode som spesifiserer aminosyrer, og denne regulatoriske koden som spesifiserer transkripsjonsfaktor (TF) gjenkjenningssekvenser. Vi finner at ~ 15% av humane kodoner er dual-bruk kodoner ('duoner ') som samtidig spesifiserer både aminosyrer og TF-gjenkjenningssteder. Genomer inneholder også en parallell regulatorisk kode som spesifiserer gjenkjenningssekvenser for transkripsjonsfaktorer (TFer), og de genetiske og regulatoriske kodene er antatt å fungere uavhengig av hverandre, og å være segregerte fysisk i de kodende og ikke-kodende genomiske avdelingene. Potensialet hos noen kodende eksoner for å imøtekomme transkripsjonsforsterkere eller skjøtesignaler, har lenge vært anerkjent.
For at kommunikasjon skal skje, kreves det 1. Sekvensen av DNA-baser som er lokalisert i regulator-området av genet, og 2. transkripsjonsfaktorer som leser koden. Hvis én av disse mangler, kan kommunikasjonen mislykkes, genet som må uttrykkes, kan ikke oppstå, og hele prosedyren for genuttrykk mislykkes. Dette er et irreduserbart komplekst system. Genreguleringskoden kunne heller ikke oppstå trinnvis, siden hvis det var tilfelle, har koden bare den rette betydningen hvis den er fullt utviklet. Det er et eksempel på fremragende design. Det faktum at disse transkripsjonsfaktorbindende sekvensene overlapper proteinkodende sekvenser, antyder at begge sekvensene ble designet sammen, for å optimalisere effektiviteten av DNA-koden. Etter hvert som vi lærer mer og mer om DNA-struktur og funksjon, er det åpenbart at koden ikke bare ble koblet sammen ved prøving og feiling av naturlig utvalg, men at den var spesielt designet for å gi optimal effektivitet og funksjon.
 Stephen Meyer uttrykker det slik i sin utmerkede bok: Darwins tviler på s.270:
Stephen Meyer uttrykker det slik i sin utmerkede bok: Darwins tviler på s.270:
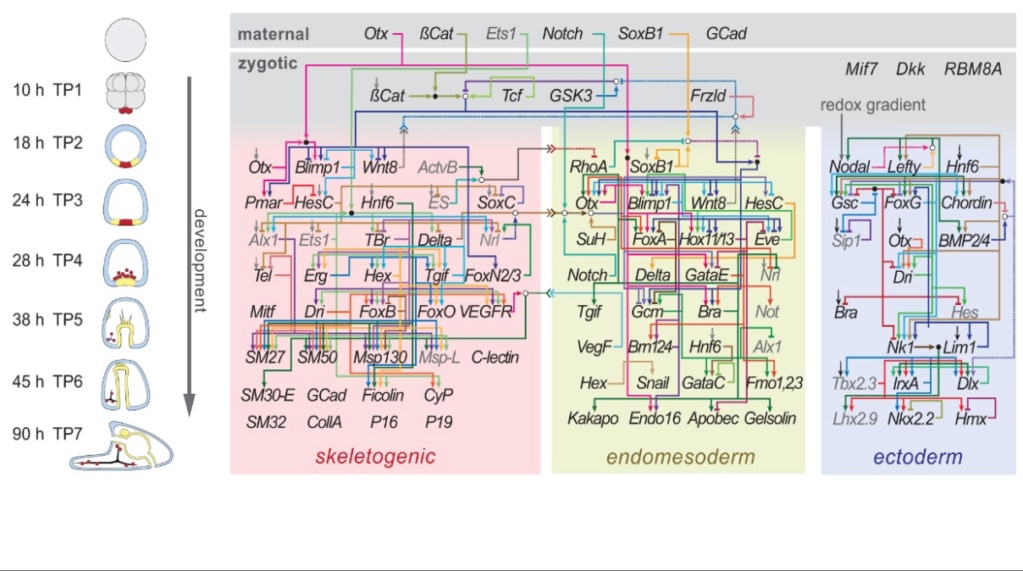
INTEGRERT KRETSLøP: UTVIKLINGS GEN REGULERENDE NETTVERK
Husk også at dyreformer har mer enn bare genetisk informasjon. De trenger også tett integrerte nettverk av gener, proteiner og andre molekyler for å regulere sin utvikling - med andre ord, de krever utviklings genregulerende nettverk, dGRNs. Dyr under utvikling står overfor to hovedutfordringer. For det første må de produsere forskjellige typer proteiner og celler, og for det andre må de få disse proteinene og cellene til rett sted til rett tid. Davidson har vist at embryoer utfører denne oppgaven ved å stole på nettverk av regulatoriske DNA-bindende proteiner. (kalt transkripsjonsfaktorer) og deres fysiske mål. Disse fysiske målene er vanligvis seksjoner av DNA (gener) som produserer andre proteiner eller RNA-molekyler, som igjen regulerer uttrykk av enda flere gener.
Disse gjensidig avhengige nettverk av gener og genprodukter presenterer et slående utseende av design. Davidsons grafiske skildringer av disse dGRN-ene ser for hele verden ut som lednings-diagrammer i en elektroteknisk tegning eller en skjematisk oversikt over en integrert krets, en uhyggelig likhet Davidson selv ofte har lagt merke til. "Det som kommer frem, fra analysen av dGRNs av dyr, "humrer han," er nesten forbløffende: et nettverk av logiske interaksjoner programmert i DNA-sekvensen som i det vesentlige utgjør en fastkoblet biologisk computer-enhet. "Disse molekylene danner samlet sett et tett integrert nettverk av signalmolekyler som fungerer som en integrert krets. Integrerte kretser i elektronikk er systemer av individuelt funksjonelle komponenter som transistorer, motstander og kondensatorer som er koblet sammen for å utføre en overordnet funksjon. På samme måte er de funksjonelle komponentene i dGRNs - de DNA-bindende proteinene, deres DNA-målsekvenser og de andre molekylene som bindingsproteinene og målmolekylene produserer og regulerer - danner også en integrert krets, en som bidrar til å oppnå den overordnede funksjonen om å produsere en voksen dyreform.
Davidson selv har gjort det klart at de stramme funksjonelle begrensningene der disse systemene av molekyler (dGRNs) opererer, utelukker deres gradvise endring ved mutasjons- og seleksjonsmekanismen. Av denne grunn har neo-darwinismen ikke klart å forklare opprinnelsen til disse systemene av molekyler og deres funksjonelle integrasjon. Som talsmenn for evolusjonær utviklingsbiologi, favoriserer Davidson selv en modell av evolusjonær endring som ser for seg mutasjoner som genererer utviklingseffekter i stor-skala, og omgår dermed kanskje midlertidige, ikke-funksjonelle kretser eller -systemer. Ikke desto mindre har verken talsmenn for "evo-devo" eller talsmenn for andre nylig foreslåtte materialistiske evolusjonsteorier identifisert en mutasjonsmekanisme som er i stand til å generere en dGRN eller noe som endog ligner en kompleks integrert krets. Likevel, etter vår erfaring, er det kjent at komplekse integrerte kretser - og den funksjonelle integrasjonen av deler i komplekse systemer generelt - produseres av intelligente agenter - spesielt av ingeniører. Videre er intelligens den eneste kjente årsaken til slike effekter. Siden utviklende dyr benytter en form for integrerte kretsløp, og absolutt ett som manifesterer et tett og funksjonelt integrert system av deler og delsystemer, og siden intelligens er den eneste kjente årsaken til disse funksjonene, synes den nødvendige tilstedeværelsen av disse funksjonene i utvikling av kambriumdyr å indikere at et intelligent agentur spilte en rolle i deres opprinnelse.
 Kalsiumkoden
Kalsiumkoden
http://stke.sciencemag.org/content/2001/89/tw4
Steady-State stomatal-lukking kunne gjenopprettes hvis kalsiumsvingninger lik naturlig type, ble påført; således har cellene en intakt nedstrøms signalvei, men kan ikke starte riktig kalsium-oscillasjonskode for å utløse banen.
Definerte endringer av cytosolisk Ca2+ -konsentrasjon utløses av cellulære og andre budbringere, slik som NAADP, IP3, IP6, Sphingosine-1-Phospate og cADPR, og det er tydelig at identiteten og intensiteten til en spesifikk stimulusimpuls resulterer i stimulusspesifikk og dynamiske endringer av cytosolisk Ca2+ konsentrasjon. Denne heterogeniteten av økning i cytosolfri Ca2+ ionkonsentrasjon når det gjelder varighet, amplitude, frekvens og romlig fordeling ledet A.M. Hetherington og kolleger til å formulere konseptet "Ca2 + signaturer". Signalinformasjon vil bli kodet av en spesifikk Ca2+ signatur som er definert av presis kontroll av romlige, tidsmessige og konsentrasjons-parametere for endringer i cytosolisk Ca2+ konsentrasjon.
RNA-koden
http://www.nature.com/nature/journal/v542/n7642/pdf/542503a.pdf
I 2004 sammenlignet onkolog Gideon Rechavi ved Tel Aviv University i Israel og hans kolleger alle menneskelige genomiske DNA-sekvenser som da var tilgjengelige med deres tilsvarende messenger-RNAer - molekylene som bærer informasjonen som er nødvendig for å lage et protein fra et gen.
De lette etter tegn på at en av nukleotidbyggesteinene i RNA-sekvensen, kalt adenosin (A), hadde endret seg til en annen byggestein kalt Inosin (I). Denne 'A-til-I-redigeringen' kan endre et proteins kodende sekvens, og hos mennesker er det avgjørende for å holde den medfødte immunresponsen i sjakk. "Det høres enkelt ut, men i virkeligheten var det veldig komplisert," husker Rechavi. "Flere grupper hadde prøvd det før og mislyktes" fordi sekvenseringsfeil og enkelt-nukleotidmutasjoner hadde gjort dataene støyinfisert. Men ved hjelp av en ny tilnærming til bioinformatikk avdekket teamet tusenvis av steder i transkriptomet - det komplette settet med mRNAer som ble funnet i en organisme eller en cellepopulasjon - og senere studier økte tallet til millioner.
Inosine er noe av et spesielt tilfelle: Forskere kan lett oppdage denne kvisen i rustningen ved å sammenligne DNA- og RNA-sekvenser. Men minst en fjerdedel av mRNAene våre inneholder kjemiske tagger - dekorasjoner til A-, C-, G- og U-nukleotidene - som er usynlige for dagens sekvenseringsteknologier. (Lignende kjemiske koder, kalt epigenetiske markører, finnes også på DNA.) Forskere er ikke sikre på hva disse kjemiske endringene i RNA gjør, men de prøver å finne ut av det. En bølge av studier de siste fem årene - hvorav mange fokuserer på et spesifikt RNA-merke kalt N6-metyladenosin (m6A) - har kartlagt disse endringene på tvers av transkriptomer og vist deres betydning for helse og sykdom. Men problemet er stort: Disse merkene dekker ikke bare mRNA, men også andre RNA-transkripsjoner, og de dekker alle livets domener og utover, og markerer til og med virus med sin tilstedeværelse.
Endringene i seg selv er ikke nye. Det som har gitt dem mening og drevet epitranscriptomics i søkelyset, er oppdagelsen av enzymer som kan legge til, fjerne og tolke dem. I 2010 foreslo kjemisk biolog Chuan He ved University of Chicago, Illinois, at disse kjemiske kodene kunne være reversible og viktige regulatorer for genuttrykk. Ikke lenge etter demonstrerte gruppen hans den første 'sletteren' av disse merkene på mRNA, et enzym kalt FTO. Den oppdagelsen betydde at m6A ikke bare var et passivt merke - celler kontrollerte den aktivt. Og denne erkjennelsen kom omtrent samtidig som globale tilnærminger, utnyttet kraften ved neste generasjons sekvensering, gjorde det mulig å kartlegge m6A og andre modifikasjoner på tvers av transkriptomet.
http://www.garlandscience.com/res/pdf/9780815341291_ch08.pdf
Oversettelse ved Asbjørn E. Lund
 Hentet herfra.
Hentet herfra. Hentet herfra.
Hentet herfra. kompleksitet, form, kontrollering av organismenes tilpasning, endring, regenerering/reparasjon og å fremme overlevelse.
kompleksitet, form, kontrollering av organismenes tilpasning, endring, regenerering/reparasjon og å fremme overlevelse. 13. DNA-metyleringskoden
13. DNA-metyleringskoden 31. RNA-koden
31. RNA-koden Transkripsjonsfaktorkoden: Det å definere rollen til en utviklings transkripsjonsfaktor i den voksne hjernen. For at den menneskelige hjerne skal utvikle seg og fungere riktig, må hver av dens 100 milliarder nevroner følge en spesifikk og forhåndsprogrammert kode for genuttrykk. Denne koden er drevet av viktige transkripsjonsfaktorer som regulerer uttrykket av mange proteiner, og støper nevronenes identitet for å skape deres unike form og elektriske oppførsel.
Transkripsjonsfaktorkoden: Det å definere rollen til en utviklings transkripsjonsfaktor i den voksne hjernen. For at den menneskelige hjerne skal utvikle seg og fungere riktig, må hver av dens 100 milliarder nevroner følge en spesifikk og forhåndsprogrammert kode for genuttrykk. Denne koden er drevet av viktige transkripsjonsfaktorer som regulerer uttrykket av mange proteiner, og støper nevronenes identitet for å skape deres unike form og elektriske oppførsel. KONTROLL AV OMSKRIFT VED SEKVENSER SPESIFIKKE DNA-BINDENDE PROTEINER
KONTROLL AV OMSKRIFT VED SEKVENSER SPESIFIKKE DNA-BINDENDE PROTEINER er viet til transkripsjonsregulatorer. Transkripsjonsregulatorer må gjenkjenne korte, spesifikke cis-regulatoriske sekvenser innenfor denne strukturen. Utsiden av den dobbelte heliksen er fylt med DNA-sekvensinformasjon som transkripsjonsregulatorer gjenkjenner: kanten på hvert basepar viser et særegent mønster av hydrogenbindings-givere, hydrogenbindings-akseptorer og hydrofobe flekker i både store og mindre spor. De rundt 20 kontaktene som vanligvis dannes ved protein-DNA-grensesnittet, legges sammen for å sikre at interaksjonen både er veldig spesifikk og veldig sterk.
er viet til transkripsjonsregulatorer. Transkripsjonsregulatorer må gjenkjenne korte, spesifikke cis-regulatoriske sekvenser innenfor denne strukturen. Utsiden av den dobbelte heliksen er fylt med DNA-sekvensinformasjon som transkripsjonsregulatorer gjenkjenner: kanten på hvert basepar viser et særegent mønster av hydrogenbindings-givere, hydrogenbindings-akseptorer og hydrofobe flekker i både store og mindre spor. De rundt 20 kontaktene som vanligvis dannes ved protein-DNA-grensesnittet, legges sammen for å sikre at interaksjonen både er veldig spesifikk og veldig sterk. Stephen Meyer uttrykker det slik i sin utmerkede bok: Darwins tviler på s.270:
Stephen Meyer uttrykker det slik i sin utmerkede bok: Darwins tviler på s.270: Kalsiumkoden
Kalsiumkoden